16 ноября 2025
Одна из вещей, на которую я всегда реагирую и довольно остро, конечно, после откровенного хамства, это на попытки перекладывания ответственности. Это когда взрослый человек, обладающий теми же взрослыми характеристиками, что и ты, пытается за твой счет - финансовый, эмоциональный, физический - решить свои проблемы. Причем это не про близких людей. И не про «словами через рот» с прояснением твоих возможностей/границ и готовности, а манипуляциями, надутыми или поджатыми губами, внезапными странными лицами, упреками, обвинениями и прочим бредом. Это примерно как в фильме «Влюблен по собственному желанию», когда библиотекарю Верочке какая-то посторонняя тетя пытается всучить ответственность за ожидание водопроводчика. И на слова Верочки, что она занята и не может ничем помочь, тетка возмущена и задает вопрос: «А мне что делать?!» и на закономерный ответ - понятия не имею, злобно шипит, что ей Веру совсем иначе рекомендовали. Вот как раз в этом моменте видны твои собственные прорехи в границах. На том же примере Верочки - она настолько часто соглашалась быть использованной, что ни у кого не возникало и тени сомнения, что с ней так нельзя. Подобные манипуляторы всегда пасутся рядом с большим и сильным ресурсом. Или с добросердечным и от этого сильным. Или с щедро душевным и мягким. Большие и сильные не замечают, сколько прилипал присосалось к брюху. Добросердечные готовы всех обогревать. Щедрые не допускают, чтобы кто-то в чем-то нуждался и раздают то, чего у них много. А мягкость в обращении не дает возможности четко обозначить границы. И все эти прекрасные люди искренне считают, что остальные сами будут понимать, где усталость, где бестактно, где надо остановиться с просьбами. Меряют по себе. Но это так не работают. «На всякого мудреца довольно простоты». И основное - это научиться сперва замечать тот момент, когда от обычных и нормальных просьб люди переходят грань. Где пробуют границы на прочность. Где взрослые люди начинают вести себя, как дети. К примеру, ваш коллега просит оказать услугу. У вас есть возможность и время. И первый раз он говорит спасибо. Но на второй раз «спасибо» куда-то исчезает, а в третий раз- это уже не просьба, а как будто так и должно быть. Или подруга просит посидеть с ребенком. Вы соглашаетесь. Затем еще раз. А потом на ваш отказ обижается, надувается, начинает общаться холодно. Или партнер надувается, если вы по какой-то причине не хотите сегодня заниматься сексом/идти в кино или просите немного уединения. Или родители упрекают вас в том, что вы занимаетесь своей жизнью, а не их. И так до бесконечности. И вот эти вот все рациональные объяснения и согласие действовать на чувстве вины/стыда, которые внушаются вам, или нежелание встречаться с обидой и недовольством другого взрослого (да и ребенка) приводит к порочному кругу. Где одни все время что-то должны, а другие - никак не взрослеют.
Показать полностью…

Многие люди сталкиваются с проблемами в отношениях, потому что реальность не соответствует их ожиданиям. Из-за навязанных обществом нереалистичных и основанных на фантазиях ожиданий многие люди уверены, что любовь должна выглядеть и чувствоваться определенным образом, и мучительно страдают от мысленного списка обязательств: «Нужно всегда чувствовать себя влюбленным. Нужно всегда хотеть секса (или по крайней мере два-три раза в неделю). Нужно выглядеть таким же счастливым, как все мои друзья в соцсети. Нужно всегда хотеть видеть своего партнера. Нужно всегда чувствовать влечение. Никогда нельзя чувствовать раздражение. Нужно сверкать, как фантик от конфеты». Но спросите любую пару, состоящую в браке более двадцати лет, и они скажут вам, что фантики – это не то, на чем основывается брак. Они могут украсить вашу повседневную жизнь сладким поцелуем или приятным разговором, но не они являются основой брака. Опытные пары знают, что такое любовь, и они знают, чем она не является. Они знают, что любовь – это не: • безрассудная страсть. Отношения могут начинаться как взрыв возбуждения и страсти, бабочки и фейерверки, но это не настоящая любовь. Они могут начинаться по-другому, и это не делает их хуже. В конце концов пламя угасает и начинается процесс познания истинной любви; • решение всех ваших проблем или недостающая часть вашего пазла. Единственный человек, который может спасти вас от ваших проблем, – это вы сами. Единственный человек, который может создать в вас ощущение радости и целостности, – это вы сами; • попытка воссоздать образ из романтической комедии или журнала; • непоколебимая уверенность в том, что вы встретили «свою судьбу»; • увлекательный разговор при каждой встрече; • ежесекундное влечение к своему партнеру; • легко; • все время нравиться друг другу. Ваш партнер будет раздражать вас до скрипа зубов. Это нормально. А теперь давайте разберемся, что такое любовь. Любовь – это: • действие. Когда вы действительно любите кого-то, вы узнаете язык его любви и стараетесь как можно чаще выразить свою любовь на том языке, который в состоянии понять ваш партнер. • выбор. Мы решаем рискнуть и полюбить. Мы выбираем открыть свое сердце нашему преданному партнеру. Мы решаем разрушить барьеры страха, которые пытаются убедить нас бежать. Мы решаем бросить вызов ложным убеждениям и нереалистичным ожиданиям, распространяемым массовой культурой, которая говорит, что вы должны быть на сто процентов уверены, что вы с «правильным» человеком, «тем самым», вашей второй половинкой. • усилие. Настоящая любовь попросит вас принять усилие и выйти за пределы своей зоны комфорта; • возможность расти и познавать себя. Любовь приглашает вас открыть свое сердце даже тогда, когда вам обычно хочется закрыться или убежать в страхе. Любовь толкает вас на край пропасти, где вам будет предложено взять на себя полную ответственность за свои боль, страх и старые раны, вместо того чтобы проецировать их на партнера. • риск. Любовь говорит: «Рискните всем, что у вас есть. Рискните всем, что вы знаете. Рискните безопасностью и привычностью своей спокойной жизни». Потому что, когда вы решаете сказать «да» любви, вы подвергаете свое сердце риску быть раненным. Большинство из нас строит тщательно продуманную защиту, чтобы избежать этого риска, вплоть до убеждения себя уйти из любящих, прекрасных, честных отношений, в то время как правда заключается лишь в том, что мы слишком напуганы, чтобы рискнуть полюбить.
Показать полностью…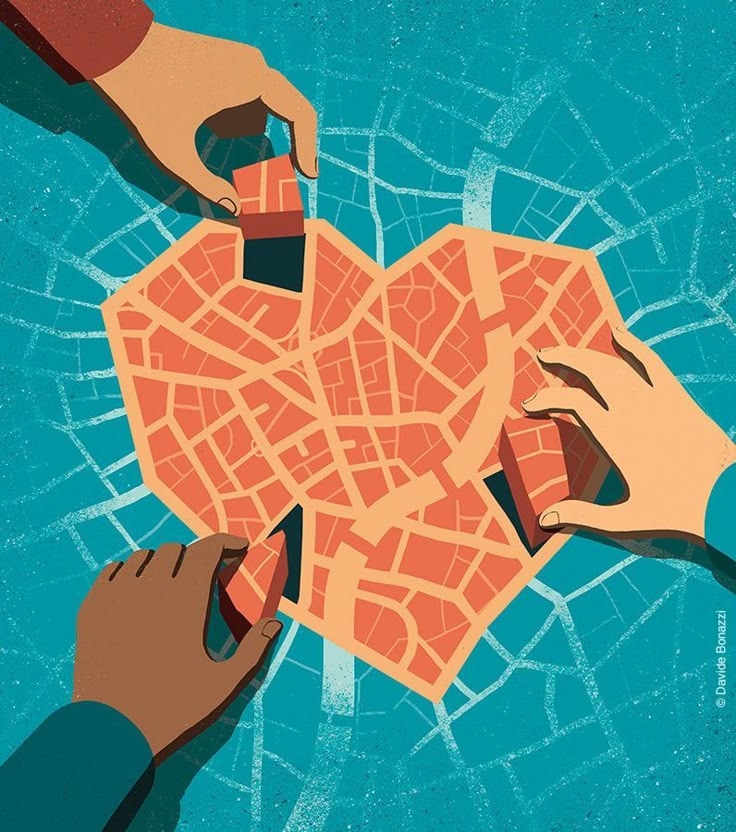

ВЫСОКОМЕРИЕ И СНИСХОДИТЕЛЬНОСТЬ
При общении мы либо признаём, либо отрицаем равенство между людьми. Третьего не дано. Проявить высокомерие или снисходительность - это два способа коммуникации, которые формируют особую динамику взаимодействия.
Высокомерный человек выстраивает контакт из позиции жёсткого разрыва связи. Он не просто ставит себя выше других, но и активно разрушает саму возможность диалога на равных. Его поведение - это монолог, а не взаимодействие. Вместо обмена возникает одностороннее давление, где один участник отказывается признавать другого значимым. Высокомерие часто связано с защитным механизмом - страхом оказаться "на одном уровне" с тем, кого человек считает недостойным. Это не просто демонстрация превосходства, а попытка полностью исключить другого из зоны значимого взаимодействия.
Снисходительность, напротив, сохраняет видимость контакта, но искажает его природу. Здесь есть диалог, но он строится по модели "сверху вниз". Снисходительный человек как бы "разрешает" другому участвовать в общении, но на своих условиях - с позиции покровителя, наставника или того, кто "терпит" собеседника. Это форма манипулятивного включения: физически контакт есть, но психологически он неравноправен. В отличие от высокомерия, которое отталкивает, снисходительность создаёт иллюзию близости, что делает её более коварной.
Интересно, что оба стиля могут быть реакцией на тревогу. Высокомерие часто маскирует страх собственной несостоятельности, а снисходительность - потребность контролировать ситуацию, чтобы избежать неожиданностей в общении. Однако если высокомерный человек отгораживается от других, то снисходительный - включает их в свою систему координат, но только в подчинённой роли.
С точки зрения здорового контакта, оба подхода нарушают его главный принцип - взаимодействие на равных. Разница лишь в том, как именно это происходит: через открытое отрицание другого или через формальное признание, лишённое подлинного уважения.


Когда женщина наконец осознаёт, что жила в созависимых отношениях, её первым порывом часто становится тотальное обесценивание партнёра. Кажется, что если превратить его в монстра, разорвать психологические путы будет проще - отряхнулась и пошла. В этом есть своя логика: так проще оправдать накопившуюся злость, приглушить стыд за прожитые с этим невыносимым человеком годы и наконец разрешить себе ненавидеть его за всё, что он [не] сделал.
Но обесценивание не освобождает, а только закрепляет зависимость. Бесконечные вопросы "где были мои глаза?" и перемывание костей бывшему лишь раздувают его фигуру в психике. И вот он уже не тот, с кем вы не сошлись характерами и не смогли вовремя расстаться, а эталонный абьюзер, демон, манипулятор, незримо управляющий тобой даже после расставания.
Ирония в том, что к созависимости приводит как раз привычка жить чувствами других. И теперь она направлена на того, от кого хочется освободиться. Вместо того чтобы обратиться к себе, женщина продолжает фокусироваться на его недостатках, его вине, его ошибках, его невыполненных обещаниях.
Пока женщина не признает, что её дефициты, невысказанные ожидания и детские иллюзии участвовали в создании этих отношений, она остаётся заложницей прошлого. И тогда выбор у неё невелик: либо бояться отношений вообще, либо снова выбирать похожее - больное, неподходящее, опасное, потому что это хотя бы привычно, знакомо и "лучше, чем ничего".
На этапе, когда женщина хочет жаловаться и обвинять, помочь ей не получится. Да и запрос тут, как правило, заключается в том, чтобы доказать себе и всем остальным, что произошедшее никак от тебя не зависело, и ничего нельзя было сделать. Это внешний локус контроля: "со мной это случилось", "он меня влюбил, использовал, испортил и т.д.", "меня заставили", "мне пришлось". Пока ты веришь, что твою жизнь определяют другие, изменения невозможны.
Настоящая трансформация начинается там, где перестаёшь осуждать партнёра и готова встретиться с собой. Со своим бессилием изменить прошлое и другого человека. С разочарованием в себе. С собственными иллюзиями и несбывшимися ожиданиями. С болью от осознания, что ты годами не была счастлива, потому что боялась одиночества.
Это неприятно и болезненно, и это нужно пережить, чтобы вернуть себе власть над собственной жизнью, где ты больше не жертва обстоятельств, а автор своей судьбы - со всеми её взлётами, падениями и возможностями для роста.